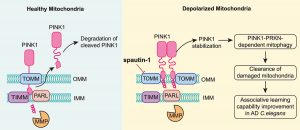
澳門大學健康科學學院教授沈漢明的研究團隊發現,在線粒體受損傷的情況下,自噬抑制劑(spautin-1)靶向線粒體外膜轉運體(TOMM)複合物中的TOMM70,能夠促進線粒體自噬並有效清除受損的線粒體。團隊同時在線蟲模型研究中發現,spautin-1通過促進線粒體自噬明顯改善了阿茲海默症線蟲模型的聯想學習能力。相關研究成果已發表在國際知名期刊《自噬》。
線粒體自噬是一種選擇性自噬,可以通過自噬—溶酶體途徑清除受損的線粒體。有研究發現,spautin-1可通過靶向抑制去泛素化酶USP10(deubiquitinating enzyme 10)和USP13(deubiquitinating enzyme 10)的活性,調控VPS34-VPS15-BECN1激酶複合物的功能,從而抑制由雷帕黴素或饑餓誘導的自噬,然而spautin-1對選擇性自噬如線粒體自噬的作用目前尚未有文章報導。
研究團隊首先發現,當使用線粒體自噬誘導劑(CCCP、valinomycin、oligomycin/antimycin A)誘導線粒體損傷時,spautin-1能有效促進線粒體自噬,清除細胞內受損的線粒體,並且實驗中使用的spautin-1濃度並不影響細胞的存活和線粒體的糖酵解功能。而且,該過程不依賴spautin-1已知的靶分子USP10和USP13。為更深入了解spautin-1促進線粒體自噬的機制,研究團隊將目光轉向線粒體自噬的關鍵激酶PINK1,並發現spautin-1抑制PINK1進入線粒體內膜被水解剪切,增加了PINK1在線粒體外膜的穩定性和聚集。為了進一步研究spautin-1對PINK1的調控作用,研究人員首先利用分子對接技術初步預測了spautin-1與線粒體內、外膜轉運複合物的結合能力,結果提示spautin-1可與線粒體外膜轉運體中的TOMM70、TOMM40和TOMM20結合。隨後研究團隊使用合成了帶有生物素的spautin-1(bio-spautin-1),並通過生物素pulldown技術,證實spautin-1與TOMM70的結合能力最顯著。接下來,研究團隊利用CRISPR-Cas9技術,構建了TOMM70敲除細胞,發現TOMM70的敲除促進了PINK1在線粒體外膜的穩定和活性,此作用與spautin-1的作用結果一致。此外,TOMM70的敲除顯著減弱了spautin-1穩定PINK1的作用,提示TOMM70是spautin-1穩定PINK1並促進線粒體自噬的重要靶分子。
鑒於線粒體自噬受損是參與阿茲海默症發病機理的重要因素,在阿茲海默症發病過程中扮演關鍵角色。研究團隊在mito-Rosella線蟲模型證實spautin-1可啟動線蟲神經元PINK-1-PDR-1(類似於哺乳動物的PINK1-PRKN通路)介導的線粒體自噬,並可改善阿茲海默症動物模型聯想學習能力。綜上所述,此研究發現spautin-1是一個特異性的線粒體自噬的激動劑,其主要機理是通過正向調控PINK1在線粒體外膜上的穩定性和活性,並證實spautin-1在線蟲模型中通過促進線粒體自噬來改善阿茲海默症的病理症狀。因此,spautin-1具有進一步轉化研究的潛力。
是次研究的通訊作者為沈漢明,第一作者為蘭州大學基礎醫學院副教授易娟、中山大學中山醫學院副教授盧廣和挪威奧斯陸大學博士生王鶴齡。蘭州大學副校長王銳院士的團隊、副教授張海龍,挪威奧斯陸大學副教授方飛,浙江大學教授夏大靜、副教授吳一華,湖南大學教授王立明等對研究給予了大力支持。研究由澳門特別行政區科學技術發展基金(檔案編號:0031/2021/A1、0078/2020/A2和0081/2022/AMJ)、澳門大學(檔案編號:SRG2020-00002-FHS、CPG2020-00029-FHS和CPG2021-00004-FHS)、國家自然科學基金(檔案編號:31701206)、甘肅省自然科學基金(檔案編號:20JR5RA281)、教育部“多肽藥物”創新團隊專案(檔案編號:IRT_15R27)和醫學科學創新基金(檔案編號:2019-I2M-5-074、2021-I2M-1-026、2021-I2M-3-001、2022-I2M-2-002)等資助。完整文章可查閱:https://www.tandfonline.com/doi/full/10.1080/15548627.2024.2383145#abstract。
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 梁雄業 | 電話:(853) 88228322 |
| 電郵: | prs.media@um.edu.mo |