澳門大學健康科學學院副教授周昶行帶領的研究團隊發現一種新型的腸炎弧菌毒素RhsP,顛覆了人類對Rhs類毒素自水解和C端毒性部分釋放機制的理解,為了解腸炎弧菌如何與人體內腸道菌群爭奪生存空間和導致腸胃炎奠定了基礎理論。相關研究成果已獲國際知名期刊《細胞報導》(Cell Reports)刊登。
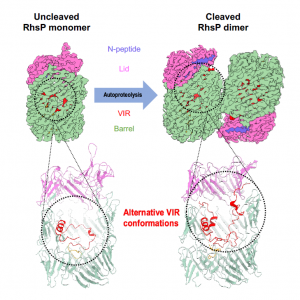
每年全球有24億腸胃炎(Gastroenteritis)患者,其中主要感染途徑之一是進食被腸炎弧菌(Vibrio parahaemolyticus)污染的海鮮。腸炎弧菌需要通過其6型分泌系統(T6SS)來釋放毒素,攻擊和殺死人體內腸道菌群(Gut microbiota),從而競爭腸道內的生存空間。周昶行的研究團隊發現一種新型的腸炎弧菌毒素RhsP,該毒素通過T6SS二型釋放到鄰近細菌體內,抑制並殺死鄰菌,而腸炎弧菌自身則會製造免疫蛋白RhsPI來中和其毒素之毒性,避免自我殺害。RhsP是一個龐大的毒素蛋白,共有1381個胺基酸,總份子量為157kDa,該毒素以一個巨大的β桶結構為主體,桶內則有重要的自水解(Autoproteolysis)功能部分。
研究團隊獲中國科學院上海同步輻射光源支持,利用結構生物學技術揭示了腸炎弧菌RhsP毒素C端之毒性部分(RhsPC)和RhsPI免疫蛋白複合體的蛋白晶體結構,並解釋免疫蛋白中和毒性和避免病菌自殺之份子機制,此結構是第一個在澳門以X光晶體學技術揭示的新型蛋白結構。
此外,研究隊伍與中國科學院廣州生物醫藥與健康研究院(GIBH)研究員何俊的團隊合作,利用世界領先的冷凍電子顯微鏡和基因誘變技術,把RhsP毒素鎖定在自水解之前和之後的型態,並以冷凍電子顯微鏡揭示各型態之份子結構。團隊發現自水解會導致RhsP毒素二聚化(dimerization),揭示了毒素透過自水解改變份子結構來釋放C端毒性部分之機理,而這對於腸炎弧菌攻擊鄰菌起到了關鍵作用。該結構是第一個在澳門利用冷凍電子顯微鏡技術揭示的新型蛋白結構。
是次研究的通訊作者為周昶行、何俊和前澳大健康科學學院副教授鄭軍。前澳大健康科學學院博士後唐樂和Nadia Rasheed、澳大健康科學學院博士生胡巧穎、中國科學院廣州生物醫藥與健康研究院博士生董淑琪和實驗室助理周寧坤為第一作者。該項目由澳門特別行政區科學技術發展基金(檔案編號:0009/2018/A1、0058/2018/A2、0113/2019/A2和0032/2021/A1)和澳門大學(檔案編號:MYRG2018-00221-FHS和MYRG2019-00050-FHS)資助。研究文章全文可瀏覽https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01610-2
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 鄭家宜 | 電話:(853) 88228009 |
| 電郵: | prs.media@um.edu.mo |