澳門大學健康科學學院副教授代雲路的研究團隊成功研發新型納米藥物,將傳統放射治療介導的癌細胞凋亡轉換為細胞焦亡,進而更有效地激發系統性抗腫瘤免疫反應,抑制乳腺癌生長、復發及轉移。研究成果已刊登於著名學術期刊《先進功能材料》。
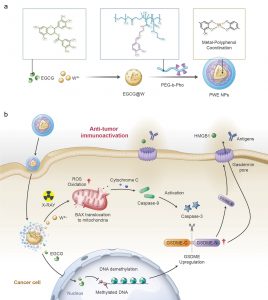
傳統放射療法方式受限於局部病灶的治療,難以有效激發系統性抗腫瘤免疫反應。放射療法主要通過引發細胞凋亡來抑制腫瘤細胞生長,而這種凋亡方式在激發體內的抗腫瘤免疫反應方面可能設置諸多障礙。發生凋亡的癌細胞仍可保持膜的完整性,其內部隱藏的豐富免疫原性損傷相關分子(DAMPs)難以釋放以喚醒周圍的免疫細胞。
研究團隊通過將功能化的天然多酚與金屬離子配位,構建了一種金屬-多酚配位納米藥物PWE,通過表觀遺傳學的方法將放射治療介導的細胞凋亡轉換為細胞焦亡,進而激發系統性抗腫瘤免疫反應。研究結果證明,兩親性PEG-多酚聚合物和DNA甲基轉移酶抑制劑(表沒食子兒茶素,EGCG)能與放療增敏劑(鎢離子,W6+)通過金屬-多酚配位的方法自組裝成核殼結構的放療增敏藥物PWE。EGCG通過抑制DNA甲基化誘導細胞焦亡的關鍵蛋白-GSDME高表達;同時金屬離子W6+在X 射線輻照下產生大量的活性氧自由基,進而通過Bax-Cytochrome c-caspase-9-caspase-3通路激活半胱天冬酶-3(Caspase-3)。激活狀態的Caspase-3可進一步將高表達GSDME 蛋白切割成為GSDME-N蛋白,進而在腫瘤細胞膜上進行打孔。HMGB1和乳酸脫氫酶(LDH)等細胞內容物隨即可通過膜上的孔洞釋放出來,高效激活系統性抗腫瘤免疫反應。在原位乳腺癌小鼠模型中發現,PWE聯合X射線輻照可以通過介導乳腺癌細胞焦亡顯著激發機體內的抗腫瘤免疫響應,抑制乳腺癌生長、復發及轉移。該種療法利用金屬-多酚配位藥物通過表觀遺傳學的方法將傳統放療介導的癌細胞凋亡巧妙地轉變為細胞焦亡,促進了傳統放療的免疫治療效果,為臨床放射治療提供了新的思路。
該研究的通訊作者為代雲路,澳大健康科學學院博士畢業生王國浩和研究助理教授李蓓為共同第一作者,博士後謝麗斯和李傑,博士畢業生桑瑋和張展,博士生田浩、顏潔和李文曦亦對該研究作出重要貢獻。該研究由澳門特別行政區科學技術發展基金(檔案編號:0109/2018/A3、0011/2019/AKP、0113/2019/A2、0103/2021/A和0002/2021/AKP)、澳門大學(檔案編號:MYRG2022-00011-FHS)及深港澳科技計劃項目(C類)(檔案編號:SGDX20201103093600004)資助。全文可瀏覽:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202213425
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 梁曉珊 | 電話:(853) 88228009 |
| 電郵: | prs.media@um.edu.mo |