澳門大學健康科學學院副教授代雲路的研究團隊成功研發出一種新型放療增敏納米藥物,能夠顯著提升放療對乳腺癌的治療效果。這種納米藥物不僅增強了放療的功效,還能逆轉放療所引發的MYC上調和免疫抑制,從而激發出強力的抗腫瘤免疫反應,有效抑制乳腺癌生長、復發及轉移。該研究成果已獲全球著名學術期刊《先進材料》刊登。
放療在臨床上對於腫瘤抑制雖然有效,但患者常常會遭受嚴重的免疫耐受和免疫抑制,主要是因為癌細胞在接受放射線治療後,會增加MYC蛋白的表達。這種蛋白質可以修復輻照引發的脱氧核醣核酸(DNA)損傷,從而促進癌細胞的增殖並抑制 IFN-I 型干擾素信號通路。受損的IFN-I 信號進一步阻礙抗原呈遞,干擾細胞毒性 T 淋巴細胞的激活,並觸發腫瘤相關調節性 T 細胞的擴增。MYC蛋白過度表達所帶來的這些連鎖效應極大地抑制了放療效果。因此,降低腫瘤細胞中MYC水平可克服關鍵的免疫抑制障礙,並引發強大的免疫放療效果。
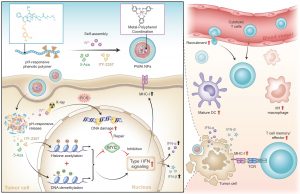
研究團隊設計了一種新型納米放射增敏劑(PWAI),目的是引發放療中的雙表觀遺傳學重編程。在PWAI合成過程中,兩親性PEG-多酚聚合物能與放療增敏劑(鎢離子,W6+)通過金屬-多酚配位的方法自組裝成核殼結構,並將5-Aza(DNA甲基轉移酶抑制劑)和ITF-2357(組蛋白去乙酰化酶抑制劑)負載到疏水核中。
在外來輻射的刺激下,X射線增敏劑 W6+ 通過產生豐富的活性氧有效地破壞了腫瘤細胞的DNA鏈;同時,釋放的表觀遺傳抑制劑用於抑制MYC蛋白。在雙重表觀遺傳學治療過程中,5-Aza雖然下調了MYC蛋白,但並未明顯觸發IFN-α/IFN-β等免疫因子的產生。當其與 ITF-2357 聯合使用時,可顯著促進對 MYC 的抑制作用;更重要的是,IFN-α和IFN-β 等IFN-I 信號相關蛋白水平和主要組織相容性復合物 I水平也得以明顯提高。研究小組進一步利用PWAI納米放射增敏劑治療乳腺癌荷瘤小鼠,觀察到小鼠接受放療後產生有效的抗腫瘤免疫響應,包括樹突狀細胞的成熟、細胞毒性T細胞的募集及其記憶表型的形成,以及腫瘤相關巨噬細胞從免疫抑制狀態到免疫支持狀態的免疫極化。因此,該種聯合放療和雙表觀遺傳學治療的治療策略為免疫放療提供一種更可行的選擇。
是次研究的通訊作者為代雲路和澳大健康科學學院研究助理教授李蓓,博士畢業生王國浩、顏潔和田浩為共同第一作者,博士後李文曦,博士生余馨穎、豐與朝和周松濤亦對該研究作出重要貢獻。此項研究由澳門特別行政區科學技術發展基金(檔案編號:0103/2021/A, 0002/2021/AKP, 0133/2022/A3, 0009/2022/AKP 和 0006/2023/ITP1)和澳門大學(檔案編號:MYRG2022-00011-FHS 和 MYRG-GRG2023-00013-FHS-UMDF)資助。研究文章的完整版本可瀏覽:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202312588
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 8822 8004 |
| 庄瑜婷 | 電話:(853) 8822 4323 |
| 電郵: | prs.media@um.edu.mo |