澳門大學健康科學學院副教授李子安和法國艾克斯馬賽大學教授彭玲首次提出小啟動RNA(saRNA)靶向調控G蛋白偶聯受體(GPCRs)的表達用於癌症治療,有效抑制多種腫瘤生長和擴散,為癌症治療提供了一種新策略。 相關研究成果已獲國際知名期刊《先進科學》(Advanced Science)以封面論文形式刊登。
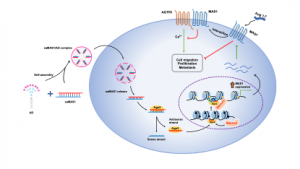
研究團隊利用saRNA靶向GPCR並研究這新方法在癌症治療中的潛力。是次研究項目的GPCR靶點 是 Mas 受體 (MAS1),可以調節腎素—血管緊張素系統 (Renin-Angiotensin System, RAS)。 RAS 在多種生理系統中發揮著重要作用,並參與腫瘤發生、進展和轉移。RAS 的失調會影響組織重塑、發炎、血管生成、細胞凋亡等過程影響並加劇腫瘤的惡性程度。因此,靶向RAS已被認為是一種調控腫瘤微環境、抑制腫瘤生長和擴散的新方法。該研究發現兩親性樹形分子(AD)可有效將把向MAS1的saRNA (saMAS1)遞送至腫瘤,並證明在多種癌細胞中能持續增強 MAS1的表達, 從而通過配體依賴和非依賴性機制抑制血管緊張素Ⅱ及其受體(AGTR1) 的信號通路,對腫瘤發生和發展有著顯著的抑制作用。
G蛋白偶聯受體(GPCRs)是藥物開發的重要靶點。目前美國食品和藥物管理局(FDA)批准的藥物中有多於30%是靶向GPCRs的。然而,已獲批的藥物僅靶向27% 左右的非嗅覺GPCRs,意味著大量的GPCRs目前是難以或不可成藥。此外,GPCRs具有多種亞型和剪接變體,以及同一亞家族內的GPCRs具有高度相似性,使得傳統的GPCRs激動劑/拮抗劑的特異性是藥物研發中的一個主要問題。因此,迫切需要開發一種有效和具有特異性的新型GPCRs靶點候選藥物。
小核酸分子,例如小干擾RNA(siRNA)和小啟動RNA(saRNA),能夠通過堿基互補配對特異性靶向並且調控基因表達。這種方法為解決不可成藥的藥物靶點(包括GPCRs)提供了獨特的優勢。與siRNA抑制基因表達相反,saRNA可增強基因表達。saRNA能夠招募RNA誘導轉錄啟動(RITA)複合物並利用其反義鏈與目標基因的啟動子區域配對,從而刺激近端基因轉錄啟動。目前,首個 saRNA 藥物 (MTL-CEBPA) 已用於晚期肝癌的臨床評估,用於靶向並上調CCAAT 增強子結合蛋白 α 的表達。
研究通過RNA啟動精准靶向GPCRs,為解決難以或不可成藥的GPCR靶點藥物的開發開闢了一條新途徑,而且提供了一種通過靶向腎素—血管緊張素系統治療癌症的新策略。研究表明saRNA 介導的增加 MAS1 表達是抑制腫瘤生長的有效方法,在癌症治療中具有廣泛的應用前景。此外,由於腎素—血管緊張素系統在多個生理過程中的多向性作用,研究開發的小啟動RNA分子也可被擴展到用於治療其他疾病,如心血管或COVID-19相關疾病。
李子安為是次研究的共同通訊作者和最後作者,其博士生熊雲芳為第一作者。博士生柯然、張慶宇、袁婉珺和本科生陳雅盈也對這項研究工作做出了重要貢獻。此次研究計劃也是健康科學學院研究小組的合作成果,成員包括副教授沈仲燮、張宣軍和謝瑞瑜。該項目得到澳門特別行政區科技發展基金(檔案編號:0016/2020/A1)和澳門大學(檔案編號:MYRG2018-00161-FHS)的支持。研究全文可瀏覽 https://onlinelibrary.wiley.com/doi/10.1002/advs.202200562
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 鄭家宜 | 電話:(853) 88228009 |
| 電郵: | prs.media@um.edu.mo |