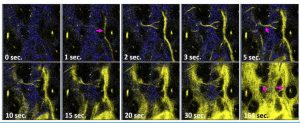
澳門大學健康科學學院副教授劉子銘的研究團隊與聖彼德堡國立大學教授Sergey P. Tunik、東芬蘭大學教授Igor O. Koshevoy和台灣大學教授周必泰共同合作,開發腫瘤微環境缺氧的創新影像量測方法,以靜脈注射錸系錯合物的磷光分子探針,穿過血管障壁後功能化膠原纖維,使組織本身成為光讀取式的氧氣濃度計,協助醫師精準切除未能被醫學影像偵測的腫瘤。該研究成果已於國際著名期刊《先進科學》(Advanced Science)中發表。
由於腫瘤的主要病灶周遭常有微小不易辨識的衛星腫瘤,難以在手術中辨識切除,具備穿透血管能力的氧氣磷光探針,可視化組織中的缺氧微環境,使腫瘤微病灶能被準確定位及清除。人體內氧氣含量對腫瘤的分化、侵襲、轉移、休眠以及增強異質性有著重要的影響,因此如何在活體內量測到異常的局部缺氧,一直是生物醫學領域的熱門議題。目前一般方法是利用微電級測量組織氧氣濃度,但在測量時需要將電極侵入性的插入到目標組織中,可能造成組織代謝紊亂,同時微電極法也不能精確辨識定位微型腫瘤所造成的組織乏氧區域。
研究團隊利用水溶性膦體與膠原靶向的磺酸基團合成了一種親水性的錸二亞胺羰基配位錯合物。該分子具有4μs的乏氧磷光壽命與40%的磷光量子效率,能線性讀取低氧下的濃度變化。而該分子探針無需預先封裝或者用樹枝狀分子進行修飾,可以通過尾靜脈注射的方式直接將探針注射到血液循環,從血管中穿透而出,與血管周邊的膠原纖維結合,產生具有良好的穩定性的氧氣磷光探針。
該研究進行了多項活體試驗,驗證磷光探針能長時間(超過6小時)監測氧氣濃度變化,其中關於腫瘤微環境的缺氧,在一個黑色素瘤的微環境中央,測得7.32 μs 磷光壽命,相當於1%的氧氣溶解,當移到腫瘤的周遭,則回復到6.7 μs,接近組織內的常氧濃度,驗證該探針能在活體內偵測腫瘤微環境的乏氧。
是次研究由劉子銘主導,其博士班研究生張志明量測雙光子磷光氧氣濃度成像。相關研究獲澳門特別行政區科學技術發展基金(檔案編號:122/2016/A3、018/2017/A1、0011/2019/AKP、和 0120/2020/A3)和澳門大學(檔案編號:MYRG2018-00070-FHS 和 MYRG2019-00022-FHS)資助。全文可瀏覽:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202102788
| 新聞來源:健康科學學院 | |
| 媒體聯繫: | |
| 澳門大學傳訊部 | |
| 李巧雲 | 電話:(853) 88228004 |
| 林祖兒 | 電話:(853) 88228022 |
| 電郵: | prs.media@um.edu.mo |
| 澳門大學創校 | |
| 40周年校慶專頁: | 40.um.edu.mo |
| 澳大網頁: | www.um.edu.mo |